FUNDAMENTOS DE
BIOLOGÍA Y FISIOLOGÍA CELULAR
PARTE 1
FISIOLOGÍA CELULAR GENERALIDADES
INTRODUCCIÓN
La presente unidad presenta un panorama general desde el punto de vista histológico de la manera en como se organizan los tejidos corporales, especialmente el referente al sistema nervioso. La fisiología se ocupa de describir las funciones que dan origen a las actividades de todas las células y de los sistemas vivientes. Por su parte la anatomía explica las estructuras que lo conforman. Se conocerá como está conformada una célula, el proceso evolutivo y los factores genéticos que intervienen en el funcionamiento de la misma. Es importante que el alumno se apropie de los conceptos y definiciones encontradas en este capítulo, ya que le servirán de base para los siguientes capítulos. Aunque existen diferencias marcadas entre las diversas células corporales, todas poseen algunas características básicas parecidas. La evolución del ser humano ha dado como consecuencia una serie de transformaciones que le permiten actuar de manera consciente y precisa ante diversas situaciones. Si bien es cierto, este proceso inicia a nivel celular, teniendo en consideración que la célula es la unidad viva, estructural y funcional de todo organismo. Los cambios que ocurren se presentan de forma paulatina, desarrollando funciones, creando nuevas estructuras y atrofiándose las que no son necesarias para el funcionamiento del órgano o sistema en general. Afortunadamente la información va pasando de generación en generación gracias a los cromosomas que, bajo condiciones normales, guardan todos estos cambios en una secuencia de ácido desoxirribonucleico (DNA).
OBJETIVOS DE APRENDIZAJE:
-
Conocer los conceptos fundamentales de la biología básica
-
Conocer la conformación estructural y funcional de la célula
Antes de comenzar a adentrarnos en la conformación estructural y funcional de la célula es importante recordar algunos conceptos básicos que nos permitirán comprender de mejor manera el contexto biológico del tema a tratar.
Iniciaremos recordando ¿que es un átomo?
El átomo es la parte más pequeña en la que puedes dividir un elemento.
El concepto de átomo de forma estricta es la partícula más pequeña en la que se puede dividir un elemento sin perder sus propiedades químicas. Inicialmente la palabra átomo, de origen griego, quiere decir “indivisible”. Hoy en día ya se conocen las partículas subatómicas de las que se compone un átomo y se sabe cómo un átomo puede ser fisionado.
Un átomo se compone de tres partículas subatómicas (electrones, protones y neutrones). Estructuralmente se compone de un núcleo, y de una corteza. En el núcleo es donde se encuentra toda la masa del átomo.
ELECTRONES: Los electrones son partículas sin prácticamente masa, y con carga negativa. Se mueven alrededor del núcleo.
PROTONES: Los protones si tienen masa y se encuentran en el núcleo del átomo, junto a los neutrones. Los protones tienen carga positiva.
NEUTRONES: Los neutrones se encuentran en el núcleo del átomo, tienen la misma masa que los protones y no tienen carga.
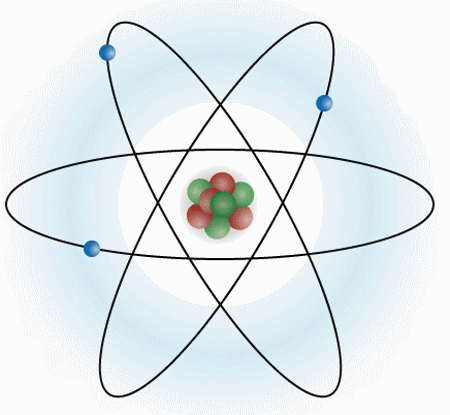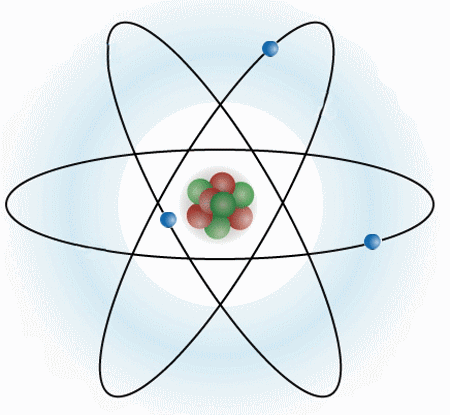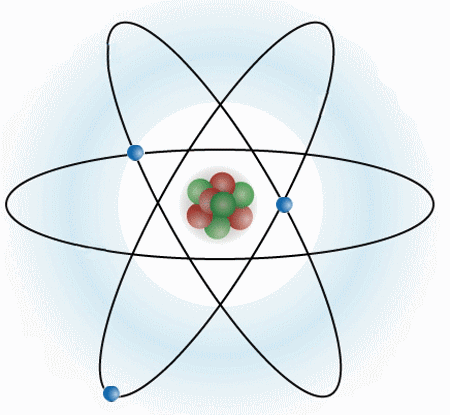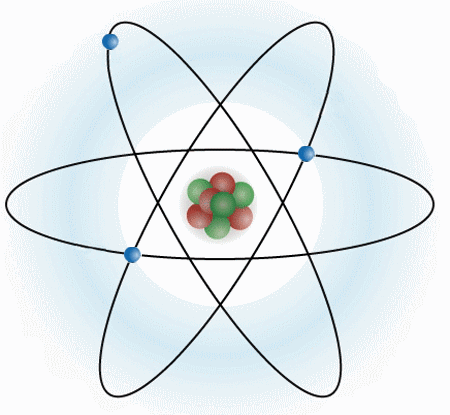

Los protones, neutrones y electrones son las partículas subatómicas que forman la estructura del átomo. Lo que diferencia a un átomo de otro es la relación que se establecen entre ellas.
ISÓTOPOS
El átomo de un mismo elemento puede variar en su número de neutrones en el núcleo. En este caso estamos hablando de un isótopo. La mayoría de los elementos tienen diferentes isótopos, que le dan diferentes características a los átomos. En isótopo más estable es el del átomo que tiene el mismo numero de neutrones que de protones. En el momento que aparece un isótopo donde hay 2 o más neutrones que protones, el átomo es inestable, y emite radiaciones, conocidas como radiactividad. Un isótopo muy conocido sería el del Carbono – 14, utilizado para poder poner fecha de antigüedad en elementos orgánicos (huesos encontrados).
MODELO DE BOHR. NIVELES DE ENERGÍA. ELECTRONES POR CAPA
Según el modelo atómico de Bohr, los electrones se mueven en diferentes órbitas específicas y cada órbita con un nivel de energía específico. Cada electrón puede saltar de una órbita a otra, liberando energía en caso de que baje a una órbita de nivel de energía inferior y absorbiéndola en caso de que suba a una órbita de un nivel de energía superior.
Cada órbita, o cada nivel puede albergar diferentes niveles pueden albergar diferente número de electrones . Según la cantidad de electrones que tenga cada átomo va completando los diferentes niveles. En el primer nivel 2 electrones, en el nivel 2 hasta 8 electrones, y así sucesivamente según la siguiente tabla:

Los átomos pierden o ganan electrones al reaccionar con otras sustancias, en base a lo que les falta o sobra para completar una capa. Un ejemplo, el hidrógeno que tiene 1 electrón, tiende a perderlo, quedándose con carga 1+. Esto es lo que se conoce como número de oxidación. Los elementos, como el Helio, que tiene sólo 2 electrones y tienen una capa estable completa, suelen ser muy poco reactivos y de ahí que se conozcan como gases nobles, por su poca o nula reactividad.
El número de electrones de cada átomo lo puedes conocer a través de la tabla periódica. La tabla periódica está ordenada por el número de protones de cada elemento. Es decir el número atómico de la tabla periódica es el número de protones. Cada átomo tiene el mismo número de electrones que de protones.
TABLA PERIÓDICA
La tabla periódica ordena a los átomos tanto por su número atómico (número de protones) como por su masa atómica y nos da gran información sobre cada uno de los elementos, según el grupo al que pertenecen.
ENLACES QUÍMICOS
Los enlaces químicos que se producen entre los átomos es la base de toda la comprensión de las propiedades de la materia, desde el punto de ebullición, de fusión, densidad, dureza, conductividad, reacciones… Aquí puedes leer todo sobre enlaces químicos, enlace iónico, enlace covalente y enlace metálico
PROPIEDADES QUE DA LA ESTRUCTURA ATÓMICA
Casi todas las propiedades físico-químicas de los elementos nos la da su átomo: la densidad, conductividad, puntos de fusión y de ebullición,… También hay algunas características como la radioactividad o fluorescencia que viene definida por la estructura atómica de los elementos.
RADIOACTIVIDAD
La radioactividad es una de las propiedades de los átomos que más atrae y asusta a la vez. Se conocen los daños que causan los elementos radiactivos, y por otro lado se conoce la gran fuerza del núcleo atómico, a través de la fisión de su núcleo.
La radioactividad, en forma de radiaciones α, β y γ se produce cuando el núcleo no tiene el número de protones y neutrones equilibrado. Puedes ver más información sobre la radioactividad aquí: radioactividad.
FLUORESCENCIA
La fluorescencia es la capacidad que tienen determinados átomos para emitir luz visible cuando son irradiados con luz ultravioleta. Es un fenómeno realmente interesante, vistoso y además útil en muchas aplicaciones.
Continuando con el orden de conceptos importantes, es preciso ahora recordar lo que es una molécula.
MOLÉCULA
Es la partícula más pequeña que incorpora todas las propiedades físicas y químicas de una sustancia.
Una molécula se encuentra formada por dos o más átomos. Los átomos que forman las moléculas pueden ser iguales (por ejemplo, la molécula de oxígeno (dioxígeno), que cuenta con dos átomos del elemento), o distintos (la molécula de agua, que tiene dos átomos de hidrógeno y uno de oxígeno). Cada molécula de una sustancia compuesta constituye la porción más pequeña de materia que conserva las propiedades químicas de dicha sustancia.
Por ejemplo, si vemos una bolsa de sal de cocina como un todo, podremos apreciar que ese todo es un polvillo de color blanco. Ahora, si observamos más de cerca, vemos que ese polvillo está conformado por gránulos diminutos de configuración espacial, como si fueran pequeñas cajitas. Estas cajitas, a su vez, están formadas por agrupamientos de varias unidades, las cuales se denominan moléculas. En el caso de la sal, las moléculas serían de cloruro de sodio.
Las moléculas sólo se hallan perfectamente individualizadas en los gases en estado de movimiento rectilíneo desordenado, en cuyo caso su interacción se limita a choques muy breves. En los líquidos, si bien las moléculas se desplazan libremente, existe un mayor contacto intermolecular. En los sólidos, las moléculas ocupan por lo general posiciones fijas en los nudos de redes cristalinas. Los agregados atómicos moleculares pueden ser polares o no polares. En el primer caso, las moléculas forman pequeños dipolos y es la atracción que se manifiesta entre éstos lo que causa la unión intermolecular. En las moléculas no polares, la unión es debida únicamente a las fuerzas de Vander Waals, que, por ser más débiles, corresponden a compuestos de bajo punto de fusión.
DIMENSIONES
Las dimensiones de la molécula dependen de las características y del número de los átomos que la forman, y pueden ir desde 2,4 ångström (molécula de hidrógeno) hasta longitudes perceptibles a simple vista (moléculas orgánicas o macromoléculas). La masa de las moléculas es extremadamente pequeña, ya que guarda relación con sus dimensiones, lo que hace evidente la necesidad de recurrir a unidades de masa especiales, tales como la molécula gramo o mol, que equivale a la masa de un cuerpo que en estado gaseoso ocupa el mismo volumen que 32 g de oxígeno (dado que la molécula de este elemento consta de dos átomos).
Por su parte, el volumen molecular, volumen ocupado por una molécula gramo de gas a 0 °C y a la presión atmosférica (760 mm de mercurio), es de 22,4 litros. Así, el número de moléculas de que consta una molécula gramo es una constante universal (conocida como «número de Avogadro»), cuyo valor es 0,023 . 1023. Las moléculas se encuentran en constante movimiento, lo que se conoce como vibraciones moleculares (que pueden ser de tensión o de flexión). Sus átomos se mantienen unidos gracias a que comparten o intercambian electrones.
Cabe destacar que las moléculas pueden ser neutras o presentar carga eléctrica. En este último caso, se las denomina Ion-molécula o Ion poliatómico. Cuando dos o más átomos iguales o diferentes se unen entre sí formando una agrupación estable, dan lugar a una molécula. Así, los gases hidrógeno (H2) y oxígeno (O2) están constituidos por moléculas diatómicas, en las cuales los dos átomos componentes son esencialmente iguales. Cuando dos átomos de hidrógeno y uno de oxígeno se unen forman el agua (H2O). Y cuando cuatro átomos de hidrógeno se enlazan con uno de carbono forman el gas metano (CH4).
FORMACIÓN
Ante la diversidad de elementos químicos existentes en la naturaleza, cabe preguntarse cuál es la razón por la que unos átomos se reúnen formando una molécula y otros no. Una primera respuesta puede hallarse en la tendencia observada en todo sistema físico a alcanzar una condición de mínima energía. Aquella agrupación de átomos que consiga reducir la energía del conjunto dará lugar a una molécula, definiendo una forma de enlace químico que recibe el nombre de enlace covalente. Esta unión química permite que dicho enlace no se disocie con facilidad y de esta manera se forma una molécula.
FORMULAS QUÍMICAS
Las sustancias compuestas se representan mediante una combinación de símbolos químicos de los elementos que las constituyen. Esta forma de representación, introducida por el químico sueco Jöhn J. Berzelius, posee un doble significado, pues no solo indica qué elementos están presentes en un compuesto dado, sino también en qué proporción los átomos respectivos participan en la formación de su molécula.
Cada símbolo en una fórmula química equivale a un átomo de la sustancia simple correspondiente. Los subíndices que pueden aparecer en una fórmula hacen referencia al número de átomos de cada molécula. Si se toma en consideración la masa de los átomos, la fórmula de una combinación química expresa, además, la proporción en masa en la que los elementos intervienen formando una sustancia compuesta dada.
Así, la fórmula del amoníaco, NH3, indica que esta sustancia resulta de la combinación de hidrógeno y nitrógeno a razón de tres átomos de hidrógeno por cada uno de nitrógeno, o, en otros términos, en la proporción de 3 x 1,008 gramos de hidrógeno por cada 1 x 14,007 gramos de nitrógeno. Este tipo de fórmula, llamada también fórmula empírica o molecular, no indica, sin embargo, nada sobre la estructura de la molécula; es decir, sobre la forma en que sus átomos componentes y los enlaces entre ellos se distribuyen en la molécula.
COMPUESTOS QUÍMICOS
Las sustancias que resultan de la unión química de dos o más elementos se denominan compuestos químicos. De esto se infiere que un compuesto va a estar formado por dos o más átomos diferentes. Y que para que un determinado compuesto se pueda formar, los átomos que lo constituyen deben unirse en proporciones fijas y exactas.
Los compuestos se representan a través de una fórmula química. Por ejemplo, la sal común se denomina cloruro de sodio y se forma al unirse un átomo de sodio con un átomo de cloro y por lo tanto, la fórmula química de este compuesto es NaCl.
Otro ejemplo es el caso de la glucosa, cuya fórmula química es C6H12O6. Esto significa que participan seis átomos de carbono, doce átomos de hidrógeno y seis átomos de oxígeno. Si se varía la proporción de átomos se formará un compuesto distinto.
CLASIFICACIÓN
Dependiendo de su composición química, específicamente, de si contienen átomos de carbono (C) o no, los compuestos químicos se pueden clasificar en dos grupos.
Así, existen los compuestos orgánicos, que son todos aquellos en los cuales el componente más importante es el carbono. Este se une con otros elementos, como pueden ser el oxígeno, hidrógeno u otros. La gran mayoría de los compuestos que existen en la naturaleza son orgánicos. Algunos de ellos son:
-
Celulosa (C6H10O5)n
-
Alcohol etílico o Etanol (CH3CH2OH),
-
Acetona(CH3COCH3),
-
Glucosa (C6H12O6),
-
Éter etílico (CH3CH2-O-CH2CH3),
-
Sacarosa (C12H22O11).
Otro grupo lo constituyen los Compuestos inorgánicos, que son todos los compuestos formados por distintos elementos, pero cuyo componente principal no es el carbono. Por ejemplo, el agua es igual a H2O, y eso es igual a 2 átomos de hidrógeno más 1 átomo de oxígeno. Otros compuestos inorgánicos son:
-
Ácido clorhídrico (HCl),
-
Agua oxigenada o (H2O2),
-
Salitre (NaNO3),
-
Bicarbonato de sodio (NaHCO3),
-
Nitrato de plata (AgNO3),
-
Ácido nítrico (HNO3),
-
Anhídrido carbónico o Dióxido de carbono (CO2).

CONFORMACIÓN ESTRUCTURAL Y FUNCIONAL DE LA CÉLULA
La célula es la unidad anatómica, fisiológica y de origen de todo ser vivo. Cada célula es una porción de materia constituida y organizada capaz de desarrollar todas las actividades asociadas a la vida: nutrición, relación y reproducción, de tal modo que se puede considerar un ser con vida propia.
En el interior de las células tienen lugar numerosas reacciones químicas que les permiten crecer, producir energía y eliminar residuos. La célula obtiene energía a partir de sus alimentos y elimina las sustancias que no necesita. Responde a los cambios que ocurren en el ambiente y puede reproducirse dividiéndose y formando células hijas.
Todos los organismos vivos están formados por células, y según tengan una o mas células, pueden ser clasificados en unicelulares (las bacterias, la euglena, la amiba, etc.) y pluricelulares (el hombre, la flora y la fauna).
Es importante conocer el cuerpo a nivel de organización celular debido a que las diversas actividades vitales se llevan a cabo en las células y, por consiguiente, en ellas se gestan los procesos tanto fisiológicos como los patológicos del organismo. El metabolismo hace referencia a todas las reacciones químicas del organismo. Las reacciones químicas involucran formar o romper los enlaces entre los átomos, según requiera el gasto celular. Cuando dos a más átomos se combinan para formar moléculas nuevas y más grandes el proceso recibe el nombre de reacción de síntesis (anabolismo). Este proceso se puede expresar de la siguiente forma: A + B A B Donde A y B son los reactivos y AB el producto final. Un ejemplo de reacción de síntesis es: 2H + O H2O Átomo de hidrógeno átomo de oxígeno molécula de agua - Por otra parte, las reacciones de descomposición (catabolismo) desdoblan o rompen los compuestos orgánicos complejos en compuestos orgánicos más simples. Una reacción de descomposición se representa de la siguiente forma: A B A + B Tomando el ejemplo anterior, donde el anabolismo del hidrógeno y oxígeno da como resultado la formación de una molécula de agua, para el caso del catabolismo tenemos: H2O 2H + O molécula de agua átomo de hidrógeno átomo de oxígeno - En tanto que casi la totalidad de las reacciones de anabolismo necesitan energía, las reacciones catabólicas proporcionan la energía requerida para que puedan llevarse acabo las primeras. Todas estas importantes y necesarias para el buen funcionamiento celular. Aproximadamente el 60 % del peso corporal de un adulto esta constituido de agua. Este líquido se encuentra distribuido en los espacios intracelular y extracelular, este ultimo se divide a su vez en dos compartimentos: espacio intersticial (entre las células) y espacio intravascular (dentro de los vasos sanguíneos). Este líquido se encuentra en constante movimiento tratando de mantener la homeostasis, sirviendo como medio de transporte de oxígeno, nutrientes, sustancias tóxicas, entre otras. Ahora bien, para que se pueda comprender como se lleva a cabo la función de las diversas estructuras orgánicas, es menester conocer la organización celular y los componentes de ella. Una célula se define como la unidad básica, anatómica y funcional del organismo. La rama de la ciencia encargada del estudio de la célula se llama citología (cit = célula; logos = tratado). Analizaremos estructuralmente una célula animal. Desde el punto de vista general, a la célula la podemos dividir en cuatro partes principales: la membrana celular, el citoplasma, los organelos y, las inclusiones plasmáticas (Figura 1).
Para que las células de un organismo funcionen, el interior de la célula (citoplasma) tiene que estar separado del exterior. La membrana de la célula está formada por una doble capa de fosfolípidos, (Los fosfolípidos son los principales componentes de la membrana celular, así como también lo son de la estructura liposomal. Forman parte de los llamados lípidos estructurales, y, como molécula, su característica principal es su caracter anfifílico, es decir una parte de la molécula tiene afinidad por el agua, hidrófila, y la otra por la grasa, lipófila. Estos fosfolípidos pueden tener distintos orígenes o fuentes; naturales, sintéticos o semisintéticos.) que comprende cabezas de fosfolípidos hidrofílicos y colas de ácidos grasos hidrofóbicos; de este modo, el agua y los solutos están en contacto con ambos lados de la doble capa de fosfolípidos pero no pueden atraversarla. Las proteínas integrales de la membrana abarcan la doble capa de fosfolípidos, permitiendo el paso de moléculas cargadas e hidrofílicas hacia el exterior o el interior de la célula. Las membranas fosfolípidas tienen que ser lo suficientemente fluidas para permitir que las proteínas encerradas por las membranas entren y salgan de la membrana misma, al tiempo que retienenh la solidez necesaria para evitar fugaz, las proteínas y los lípidos son sensibles a la temperatura, así que la función de la membrana cambia cuando la temperatura corporal del animal varía. Algunos animales sustituyen sus lípidos y proteínas al aclimatarse a temperaturas ambientales cambiantes. Los animales que se acercan a su límite térmico, corren el riesgo de aumentos de temperatura corporal capaces de alterar de forma irreversible la estructura y la función de proteínas y lípidos.
De la célula procariota a la eucariota
Células procariotas
Un hito importante en la historia de la evolución fue la aparición de las primeras células procariotas, células relativamente espontánea y evolucione para adaptarse a un nuevo azúcar como fuente de carbohidratos, o bien, que se haga resistente a determinado antibiótico. Las bacterias se clasifican en dos grandes grupos de acuerdo con su hábitat.
-
Las eubacterias, que viven en los ambientes normales (suelo, agua, plantas y otros organismos superiores)
-
Las archaebacterias, que se han adaptado a vivir en condiciones sumamente adversas (fondo del mar, fuentes termales, zonas ricas en gases sulfurosos, etc.
A pesar de su relativa simplicidad (o quizás por ello), las bacterias se alimentan con todo tipo de sustancias: azúcares sencillos o complejos, grasas, proteínas, hidrocarburos, polisacáridos, etc. Algunas incluso pueden aprovechar el CO2 como fuente de carbono y el N2 como fuente de nitrógeno.
En la actualidad son, sin duda alguna, los habitantes más abundantes del planeta Tierra, han sobrevivido durante más tiempo y probablemente son los que sobrevivirán más.

LA CÉLULA EUCARIOTA
La célula eucariota tiene en la actualidad una estructura organizada. A medida que la atmósfera se enriquecía con oxígeno, pereció una parte de las células primitivas que no pudieron adaptarse a estas nuevas condiciones. Otras desarrollaron una capacidad para respirar, o bien, tuvieron que ocultarse en lugares donde el oxígeno estaba ausente para conservar su condición de anaerobias. Sin embargo, una tercera clase descubrió que si se unía en simbiosis con una célula aerobia podía sobrevivir y desarrollarse de un forma mucho más rica.
Ésta es la hipótesis más viable para la organización metabólica de las células eucariotas de hoy día que se estudia en detalle más adelante (cuadro 1-1).
Por definición y en contraste con las células procariotas, las células eucariotas tienen una estructura organizada y disponen de un cierto número de organelos. En particular, tienen un núcleo, separado del resto de la célula mediante una membrana nuclear, que es casi por completo de DNA.

El resto de la célula está constituido por el citoplasma, lugar donde se realiza la mayor parte de las reacciones metabólicas y donde se encuentra un cierto número de organelos. Éstos se tratan con mayor detalle más adelante; entre ellos destacan:
-
Mitocondrias y cloroplastos:
-
Retículo endoplásmico liso (fino) y retículo endoplásmico rugoso (grueso);
-
Aparato de Golgi;
-
Ribosomas;
-
Lisosomas y peroxisomas;
-
Citoesqueleto;
-
Vacuolas;
-
Flagelos.
Una membrana más o menos organizada rodea la célula eucariota, como las procariotas; dicha membrana está constituida fundamentalmente por fosfolípidos y proteínas específicas que tienen diferentes funciones.
Al parecer, las mitocondrias evolucionaron a partir de algún organismo procariota que se unió en simbiosis con algún otro organismo primitivo anaerobio. En efecto, en muchos aspectos, las mitocondrias se parecen a los organismos procariotas:
-
Tienen un tamaño y forma parecidos;
-
Se multiplican por división:
-
Contienen su propio DNA;
-
El proceso de respiración se efectúa exclusivamente en ellas;
-
Muchas bacterias actuales respiran igual que las mitocondrias.

Mediante esta simbiosis, primitivos eucariotas anaerobios podrían haber sobrevivido en un ambiente cada vez más rico en oxígeno, utilizando la capacidad del procariota asociado para producir energía mediante el consumo de oxígeno atmosférico.
La adquisición de mitocondrias tuvo, sin duda, importantes repercusiones. Al ocuparse sólo de la respiración, permitió que la membrana se especializara en otras funciones, a diferencia de lo que ocurre en los procariotas; en éstos se debe conservar un gradiente importante de H+ en la membrana plasmática para producir ATP. Por consiguiente, la membrana eucariota pudo crear canales iónicos y otros organelos —receptores— especializados en el intercambio de señales.
Los cloroplastos llevan a cabo la fotosíntesis de la misma manera que las cianobacterias: absorben la luz solar con la clorofila que existe en sus membranas. También los cloroplastos manifiestan similitudes notables con las cianobacterias:
-
Son similares en forma y tamaño;
-
Las membranas en las que se encuentra la clorofila están dispuestas en capas;
-
Se reproducen por división;
-
Contienen DNA con secuencias muy parecidas al DNA bacteriano.
Todo ello apunta a que los cloroplastos evolucionaron a partir de las cianobacterias que se unieron en simbiosis a alguna célula eucariota primitiva. Este tipo de simbiosis es relativamente frecuente y,en la actualidad, se conocen células eucariotas que tienen auténticas cianobacterias en su interior.
La teoría de la evolución de los eucariotas a partir de la hipótesis simbiótica se ilustra en la siguiente figura:

TEORÍA ACTUAL DE LA ENDOSIMBIOSIS COMO ORIGEN DE LA CÉLULA EUCARIOTA
La célula eucariota se distingue también por una red proteica, el citoesqueleto, que sitúa y desplaza los organelos en la célula. Todos los vegetales, los hongos y los animales son eucariotas. Su DNA está en uno de los organelos, el núcleo.
Además del retículo endoplásmico y el complejo de Golgi, que intervienen en la síntesis de ciertas proteínas, los otros dos compartimientos que desempeñan un papel sustancial ya que suministran energía a la célula son las mitocondrias (del griego mitos, filamento, y khondros, grano), las cuales se ocupan de la respiración celular, y los plastos de los vegetales, donde tiene lugar la fotosíntesis o conversión de la energía luminosa en energía química.
Algunos organelos pueden desaparecer y volverse a formar. Es el caso del núcleo durante la división celular, del aparato de Golgi y del retículo. Pero las mitocondrias y los plastos proceden siempre de la división de mitocondrias y plastos preexistentes. A finales del siglo XIX, esta particularidad hacía pensar ya en bacterias que se dividían por bipartición en el citoplasma. Las mitocondrias y los plastos eran organismos vivos, instalados en simbiosis en la célula.
En 1883, el investigador alemán A. Schimper observó: “Si se establece definitivamente que los plastos nunca se forman de novo en la célula huevo, entonces su situación en la célula donde se encuentran recuerda la de los simbiontes. Es posible que una planta verde no sea otra cosa que la unión entre un organismo incoloro y un microbio que posee los pigmentos clorofílicos.” Otros autores le pisaron los talones a principios del siglo XX, pero toparon, lamentablemente, con la incredulidad de sus colegas. Ocurrió como con la deriva de los continentes de Alfred Wegener: los argumentos propuestos no bastaron para afianzar la intuición.
En particular, fracasaron todos los intentos de aislamiento y cultivo in vitro del microbio verde. Varios autores propusieron para estos organelos un origen autógeno a partir de repliegues de la membrana plasmática. Los progresos de la biología iban a brindar otros argumentos a la idea según la cual las mitocondrias y los plastos derivan de bacterias.
La microscopia electrónica demostró que los organelos de los eucariotas están limitados por una membrana lipídica simple, salvo tres de ellos: el núcleo, rodeado por membranas provistas de poros que lo ponen en continuidad con el citoplasma, y los plastos y las mitocondrias, separados del citoplasma por dos membranas continuas. Además, la organización de la estructura de estos dos últimos organelos evoca la de ciertas bacterias. Por ejemplo, las membranas fotosintéticas o tilacoides de los plastos de ciertas algas (las algas rojas) evocan en gran medida a los tilacoides de bacterias fotosintéticas, las cianobacterias. Los adelantos de la bioquímica pusieron de manifiesto otros parecidos sorprendentes. Los lípidos de las membranas que rodean a las mitocondrias existen en ciertas bacterias, pero no en otras partes de la célula eucariota. En cuanto a los lípidos característicos de las membranas de los plastos, se les encuentra en las cianobacterias. Además, las mitocondrias y los plastos desempeñan ciertas funciones metabólicas que efectúan también ciertos procariotas libres.
La fotosíntesis se consuma de manera casi idéntica en las cianobacterias y los plastos. Las reacciones de oxidorreducción ligadas a la actividad energética de las mitocondrias y de los plastos requieren la intervención de cadenas de transferencia de electrones membranosas parecidas a las de los procariotas: colaboran en ellas unas complejas proteínas homólogas, como los citocromos.
Pero el argumento principal fue el descubrimiento de un genoma en los plastos en 1962 y luego en las mitocondrias al año siguiente. Este DNA se parece al de los procariotas:
no está aislado dentro del organelo y se presenta en forma de varias copias idénticas de una molécula circular. El DNA se duplica y se transfiere durante la bipartición del organelo como en el caso de los procariotas libres. En las mitocondrias y los plastos existen ribosomas que sintetizan proteínas y son más pequeños que los del citoplasma de la célula. De hecho, tienen el tamaño y la composición del RNA de los ribosomas de los procariotas.
Por todas estas razones, la hipótesis del origen simbiótico de las mitocondrias y de los plastos halló adeptos en los años 1970, como Lynn Margulis, de la Universidad de Amherst (Massachusetts), y Sarah P. Gibbs, de la Universidad McGill en Montreal. La biología molecular subrayó todavía más el parentesco entre estos organelos y los procariotas. Es el caso, por ejemplo, de las zonas promotoras de los genes, es decir, de las secuencias reconocidas para proteínas que aseguran su transcripción en RNA. Se descubrieron actualmente genes homólogos (que tienen el mismo origen evolutivo) de genes bacterianos en el genoma de las mitocondrias y de los plastos. Sería sorprendente encontrar bacterias en el citoplasma de eucariotas. En realidad, semejante modo de vida no es raro entre los eucariotas: se le designa endosimbiosis. Este modo de vida es el de ciertos microorganismos patógenos, como la bacteria causante de la listerosis o de la fiebre tifoidea. Pero también, el de numerosos animales unicelulares, los protozoarios, que son colonizados por varias bacterias.
Kwang W. Jeon, de la Universidad de Tennessee, describió la aparición de una endosimbiosis entre las amebas, a raíz de una infección que diezmó un cultivo de laboratorio en 1966.
Algunas amebas sobrevivieron a la presencia de bacterias en su citoplasma: veinte años más tarde, todavía contienen unas 42 000 bacterias por célula. Pero hay más: esta asociación se ha vuelto forzosa. Las amebas ya no pueden sobrevivir si se da muerte a sus compañeros citoplasmáticos aumentando la temperatura. Otro ejemplo clásico: las plantas de la familia de las leguminosas (trébol, guisante) poseen en sus raíces unos nódulos cuyas células albergan bacterias del género Rhizobium. Estas bacterias, llegadas del suelo, ayudan a la planta a alimentarse fijando el nitrógeno atmosférico. Estos microorganismos unicelulares están rodeados siempre por dos membranas: la membrana interna, que es la de la bacteria, y la membrana externa procedente de la membrana plasmática del hospedero, que rodea a la bacteria durante su penetración en la célula. No obstante, el origen de la membrana externa de las mitocondrias y los plastos es objeto de controversia (en el caso de los plastos, contiene lípidos de tipo procariota y sería de origen mixto). ¿Cuántos sucesos de endosimbiosis han tenido lugar en el curso de la evolución? ¿Cuáles son los procariotas actuales más próximos a los que viven en endosimbiosis? La biología molecular actual puede empezar a responder estas preguntas gracias a la comparación de los genes de los organelos con los genes homólogos de los procariotas. Las secuencias de los genes se alinean y luego se comparan visualmente o por medio de programas de computadora que descubren parentescos en forma de árboles fiogenéticos. Se averigua así que las mitocondrias forman un grupo homogéneo: todas ellas descenderían de una bacteria ancestral única. Se supone que un solo suceso de endosimbiosis se produjo en un antepasado de la mayoría de los eucariotas actuales.
Se conocen descendientes directos de estos eucariotas primitivos, como el parásito intestinal Giardia. Trabajos recientes indican que el ancestro de las mitocondrias es parecido a un grupo de bacterias que usa oxígeno y que engloba, entre otros, al agente de la fiebre tifoidea, Rickettsia, y a varias bacterias simbióticas de artrópodos. Las bacterias de este grupo comparten varios caracteres con las mitocondrias, como la vida intracelular obligatoria, la utilización de oxígeno y la producción de una pequeña molécula de transferencia de energía, el ATP (trifosfato de adenosina), por medio de una vía metabólica llamada ciclo de Krebs.
Tal vez, las mitocondrias se consolidaron hace 2 000 o 3000 millones de años, en el periodo precámbrico, lo cual constituye una etapa fundamental para los eucariotas. Esta etapa supone la ventaja de la respiración celular: sin mitocondrias, la célula eucariota no puede utilizar el oxígeno para oxidar los azúcares y producir su energía. Es posible incluso que los eucariotas primitivos fueran sensibles al oxígeno, como lo son en la actualidad los eucariotas carentes de mitocondrias. Las primeras mitocondrias, al consumir el oxígeno, pudieron desempeñar el papel de protector ante las células que las albergaban: el oxígeno genera derivados tóxicos para las células que no poseen las enzimas necesarias para inactivarlos.
En la actualidad, son raros los eucariotas desprovistos de estos organelos: dicha endosimbiosis parece haber sido determinante para el éxito evolutivo de los eucariotas.
Más tarde, ciertos eucariotas que originaron los diversos linajes de vegetales habrían logrado conformar los plastos, tal vez hace alrededor de 1200 o 2 000 millones de años. La diferencia entre estos linajes son los pigmentos fotosintéticos que utilizan para captar la energía luminosa. Ya se mencionaron las algas rojas. Su equipo pigmentario recuerda el de las cianobacterias (clorofila a y ficobilisomas que les dan su color rojo). Se distinguen también los vegetales verdes, que agrupan las algas verdes y sus descendientes, los vegetales terrestres: carecen de pigmentos proteicos rojos, pero están dotados de clorofila tipo a y b. La información molecular indica que los plastos verdes y rojos habrían surgido a partir de un mismo linaje. Las cianobacterias actuales son, a menudo, simbióticas y se unen a hongos, helechos o, incluso, viven en endosimbiosis en protozoos o esponjas, por ejemplo.
Lo que puede sorprender, en cambio, es que el equipo pigmentario de los plastos verdes es muy distinto al de las cianobacterias. La pérdida de los ficobilisomas y la producción de la clorofila b se produjeron varias veces en las cianobacterias durante su evolución. En 1975, Ralph A. Lewin, de la Universidad de Yale, descubrió Prochloron, un procariota carente de ficobilisomas pero que posee clorofila b. Desde entonces se han descubierto otros organismos parecidos y se ha propuesto crear para ellos el grupo de los proclorofitos. Pero la información molecular indica que, en realidad, estos organismos aparecieron en diversas ocasiones entre las cianobacterias y forman linajes diferentes, sin ninguna relación con los plastos de los vegetales verdes. Si bien los ancestros de los plastos rojos y verdes son próximos, por no decir idénticos, parece probable que en el origen de las algas rojas y las plantas verdes hubiera dos hospederos eucariotas diferentes.
En ciertas algas, los plastos presentan la impensada particularidad de estar rodeados no de dos, sino de cuatro membranas. ¿Cómo explicarlo? Estas algas pertenecen al grupo de las heterocontas: comprende las algas pardas de las costas mexicanas, como el fucus, pero también las microscópicas diatomeas. Su plasto pardo, distinto de los plastos verdes y rojos, posee las clorofilas de tipos a y c. Entre la segunda y tercera membranas, un espacio citoplasmático contiene vesículas y microtúbulos. ¿Cómo aparecieron estos plastos especiales? Un pequeño grupo de algas unicelulares, las criptofitas, atrajo la atención: estas algas también están provistas de plastos rodeados de cuatro membranas. Pero en el espacio entre la segunda y la tercera membrana hay ribosomas de tipo eucariota y un organelo curioso, el nucleomorfo, que evoca un núcleo reducido que contiene DNA. Sarah P. Gibbs planteó la hipótesis de una segunda endosimbiosis para explicar estos plastos de cuatro membranas. Entonces, el plasto comprende, del exterior al interior, una membrana de secuestro del hospedero secundario, la membrana plasmática de un alga asimilada y luego las dos membranas del plasto de esta última.
De hecho, las algas unicelulares tienen la capacidad de desarrollarse perfectamente en el citoplasma de otros eucariotas, por ejemplo, en las células de los animales que edifican los corales y las anémonas de mar de las costas mexicanas. Las algas en cuestión, ciertas dinofiageladas, existen también en forma libre y son todavía reconocibles a la perfección. Tales estados intermedios pudieron originar asociaciones más estrechas, como en las criptofitas y en las algas heterocontas.
El DNA del nucleomorfo de las criptofitas contiene genes que corresponden a los RNA de los ribosomas que lo rodean.
El genoma del nucleomorfo está formado por tres pequeños cromosomas. Estos genes son parecidos a los de las algas rojas, y los genes ribosómicos del núcleo de la célula hospedera, la criptofita, hacen que ésta esté más emparentada con los vegetales verdes.

ESTRUCTURA CELULAR
ESTRUCTURA CELULAR
Las células son estructuras con muy buena organización en su interior; están constituidas por diferentes organelos, y cada uno de ellos cumple funciones diferentes. Sin embargo, todas las células eucariotas, que son las de todos los seres vivos con excepción de las bacterias, cuyas células son mucho más sencillas, comparten un plan general de organización:
-
Una membrana que determina su individualidad;
-
Un núcleo que contiene el material genético y ejerce el control de la célula;
-
Un citoplasma lleno de organelos, dónde se ejecutan prácticamente todas las funcione.
La célula está rodeada por una membrana, denominada “membrana plasmática”. La membrana delimita el territorio de la célula y controla el contenido químico de la misma.
Lípidos, proteínas y glúcidos forman parte de la composición química de la membrana, en proporciones aproximadas de 40, 50 y 10%, respectivamente, de acuerdo con la célula u organelo que cubra. En la membrana interna mitocondrial hay hasta 85% de proteínas, y en el sistema nervioso, sólo 15%. El tipo de lípidos también varía entre células. Los lípidos forman una capa doble y las proteínas se disponen de una manera irregular y asimétrica entre ellos. Estos componentes son móviles, lo que confiere a la membrana un elevado grado de fiuidez.
Por el aspecto y comportamiento el modelo de membrana se denomina “modelo de mosaico fluido”.
Las funciones de la membrana se resumen en:
-
Transporte, que es el intercambio de materia entre el interior de la célula y su ambiente externo;
-
Reconocimiento y comunicación, gracias a moléculas situadas en la parte externa de la membrana, las cuales actúan como receptores de sustancia.
La siguiente figura es un dibujo esquemático de una célula eucariota animal y de otra vegetal.


La membrana celular (plasmática) es una estructura muy delgada que separa el medio interno del externo. Está constituida principalmente de fosfolípidos y proteínas. Las moléculas de fosfolípidos están dispuestas en dos líneas paralelas dando lugar a una doble capa de fosfolípidos. Esta bicapa forma el esqueleto de las membranas plasmáticas. Las proteínas están clasificadas en dos grupos: integrales y periféricas. Las proteínas integrales procuran sitios de recepción que capacitan a la célula para reconocer a otras células, unirse a hormonas, nutrientes y otros elementos necesarios para su funcionamiento y responder a las células extrañas o potencialmente nocivas. Por su parte, las proteínas periféricas han sido poco estudiadas por lo que sus funciones no están bien definidas. Se presume que algunas proteínas periféricas son empleadas como enzimas que catalizan reacciones celulares. Las funciones principales de la membrana plasmática son las siguientes:
1. Ofrecer una barrera flexible que encierra un contenido celular separándolo del medio extracelular.
2. Hace accesible el contacto entre las células o algunas sustancias extrañas.
3. Contiene receptores para diferentes moléculas como los neurotransmisores, hormonas, anticuerpos o nutrientes.
4. Media la entrada y salida de moléculas al interior de la célula. El citoplasma es la sustancia que se encuentra en el interior celular bañando a los diversos organelos celulares y las inclusiones plasmáticas. Es un líquido semitransparente, contiene alrededor de 75 a 90 por ciento de agua, el resto son partículas sólidas como proteínas, carbohidratos y lípidos. Funcionalmente en el citoplasma se realizan algunas de las reacciones químicas expuestas anteriormente. Almacena compuestos químicos para después enviarlos a otra parte de la célula o incluso a otras células del organismo.
Los organelos celulares son piezas especializadas que poseen características propias y funciones específicas de acuerdo a las necesidades de la misma. El número y tipo es variable, dependiendo de que célula se trate. De manera general encontramos un núcleo generalmente oval, central y el organelo de mayor tamaño. Encierra los genes, que son los encargados de controlar la estructura y guiar las actividades de la célula; son los responsables de la herencia. Otros de los organelos encontrados en el interior de la célula son el retículo endoplásmico que, junto con los ribosomas, participan en la síntesis de proteínas; las mitocondrias, también conocidas como la “central eléctrica” celular son las responsables de la creación de la energía necesaria para el funcionamiento de la célula; el aparato de Golgi, encargado de la expulsión de diversas sustancias; los centríolos, que participan en el proceso de la mitosis o multiplicación celular. Las inclusiones celulares forman un grupo grande y variado de sustancias químicas producidas por las células, como por ejemplo, la melanina (pigmento que le da color a la piel, pelo y ojos, además de filtrar los rayos ultravioleta), el glucógeno (que tras el metabolismo produce la glucosa) y los lípidos (almacenados en adipositos que también pueden producir energía).
EVOLUCIÓN CELULAR. TEORÍA CELULAR
HISTORIA DE LA TEORÍA CELULAR.
En la actualidad se considera a la célula como la unidad morfológica y funcional de todos los seres vivos. Morfológica, en la medida en que todos los seres vivos están formados por una o más células, y funcional, en cuanto que las funciones que caracterizan al ser vivo (nutrición, relación y reproducción) también tienen lugar a nivel celular. También se suele decir que la célula es la porción más pequeña de materia viva que está dotada de vida propia: de una célula es lícito decir que "vive", mientras que no lo es decirlo de una proteína o de un ácido nucleico.
El poder realizar afirmaciones de carácter tan general como las anteriores es el fruto de muchos años de investigación acerca de la estructura y función celular, aspectos estos que constituyen el campo de estudio de la Citología, área de la Biología que en la actualidad posee claras imbricaciones con la Bioquímica, la Genética y otras muchas áreas del conocimiento biológico.

El tamaño de la mayoría de las células está por debajo del poder de resolución del ojo humano, por lo que su existencia pasó inadvertida hasta que se desarrollaron instrumentos ópticos como el microscopio compuesto, capaces de aumentar considerablemente el tamaño de las imágenes de los objetos observados. Las primeras observaciones de lo que hoy conocemos como células datan del siglo XVII, cuando el comerciante holandés Anton Van Leewenhoek construyó artesanalmente el primer microscopio conocido y pudo observar en una gota de agua procedente de una charca, gran cantidad de "animálculos" que, basándonos en sus propias descripciones, se pueden identificar hoy como microorganismos unicelulares.
En la misma época el microscopista inglés Robert Hooke, analizando con su microscopio láminas muy finas de corcho, observó que éste estaba formado por un retículo de pequeñas celdas, acuñando así el término célula (del latín cellulla = celdilla) (figura A). A pesar de que se habían dado los primeros pasos en el estudio de las células, el siglo XVIII no deparó ningún avance significativo en este campo. Fue en la primera mitad del siglo XIX cuando el perfeccionamiento de los microscopios, la puesta a punto de técnicas de tinción para aumentar el contraste de las preparaciones, y la invención de aparatos, denominados microtomos, que permiten cortar láminas muy finas de materiales biológicos, condujeron a una serie de descubrimientos que desembocaron en la formulación de la teoría celular. La constatación de que las células se encontraban presentes en todos los tejidos vivos sometidos a observación llevó al botánico M. Schleiden y al zoólogo T. Schwann a formular en 1837 dicha teoría de manera clara y precisa, afirmando que la célula es la unidad estructural y funcional de todos los seres vivos, con capacidad para mantener de manera independiente el estado vital. Pocos años más tarde, en 1855, se zanjó definitivamente una dura polémica acerca del origen de las células, descartándose la "generación espontánea" y aceptándose de manera generalizada que toda célula procede, por división, de otra célula preexistente, lo que quedó plasmado en el célebre aforismo de Virchow: "Omnis cellulla ex cellulla". Esta afirmación fue inmediatamente incorporada a la teoría celular, que en la actualidad es considerada la más amplia de las generalizaciones que se han hecho en Biología.

TIPOS DE ORGANIZACIÓN CELULAR.
Todas las células están delimitadas con respecto a su entorno por una membrana, la membrana plasmática, que encierra en su interior un contenido celular, el protoplasma, que comprende las diferentes estructuras celulares. Existen en la actualidad dos tipos diferenciados de organización celular que están representados en dos grandes estirpes celulares: las células procariotas (del griego pro = antes, y carión = núcleo) y las células eucariotas (del griego eu = verdadero, y carión = núcleo). La diferencia más patente entre ambas reside en que el material genético de la célula eucariota está delimitado del resto del contenido celular por una envoltura membranosa, dando lugar a una estructura conocida como núcleo; por el contrario, el material genético de la célula procariota se encuentra disperso, sin ninguna envoltura que lo delimite claramente, dando lugar a una estructura difusa denominada nucleoide.

La célula procariota es organizativamente más simple y evolutivamente más antigua que la célula eucariota, la cual desciende de ella. Carece de un sistema interno de membranas que la divida en diferentes compartimentos; se trata, pues, de un recipiente único rodeado de una única membrana; en realidad, la ausencia de núcleo no es más que una consecuencia de la falta de este sistema membranoso interno. Por el contrario, la célula eucariota está compartimentalizada por un extenso sistema de membranas del que la envoltura nuclear no es más que una parte especializada; este sistema membranoso da lugar a diferentes estructuras denominadas orgánulos celulares. Los organismos procariontes (formados por células procariotas) son siempre unicelulares, mientras que los eucariontes (formados por células eucariotas) pueden ser unicelulares o pluricelulares. En la anterior se resumen las principales diferencias entre los dos principales tipos celulares.
Por otra parte, las células eucariotas se dividen a su vez en dos grandes tipos: las células animales y las células vegetales, que se distinguen por la posesión exclusiva de determinados orgánulos o estructuras, como los centriolos, exclusivos de la célula animal, o los cloroplastos y la pared celular, exclusivos de la célula vegetal. La moderna taxonomía clasifica a los seres vivos en cinco Reinos: Moneras, Protistas, Hongos, Animales y Vegetales. Los organismos procariontes pertenecen en su totalidad al Reino Moneras mientras que los otros cuatro Reinos están integrados por organismos eucariontes.
FORMA Y TAMAÑO DE LAS CÉLULAS
En medio acuoso las células tienden espontáneamente a adoptar una forma aproximadamente esférica. Sin embargo, la forma de las células vivas puede ser muy variada y viene determinada por su función o por la proximidad de células vecinas. Así existen células de forma poligonal, poliédrica, prismática, cilíndrica y otras muchas. Algunas células presentan formas muy sofisticadas, de aspecto estrellado o arborescente, como es el caso de las neuronas, y otras presentan incluso la capacidad de cambiar de forma en el transcurso del tiempo. La mayor parte de las células son de tamaño microscópico. Generalmente, las células procariotas tienen dimensiones que oscilan entre 1 y 2 μm mientras que en las células eucariotas, animales y vegetales, lo hacen entre 10 y 30 μm. En los organismos pluricelulares el tamaño global del organismo no está en función del tamaño de sus células constituyentes sino del número de éstas: un elefante tiene muchas más células que una hormiga pero éstas son de tamaño similar en ambas especies; el organismo humano tiene unas 10 células.
Cabe preguntarse por qué en el curso de la evolución se ha favorecido este tipo de tamaños celulares, es decir, por qué las células no son en general más grandes o por qué no son más pequeñas. Probablemente, el límite inferior en tamaño viene marcado por el número mínimo de biomoléculas y estructuras supramoleculares que la célula necesita para mantener el estado vital. Las células más pequeñas, ciertas bacterias denominadas micoplasmas, miden unos 0,3μm (300 nm) y no parece que células más pequeñas pudieran albergar la maquinaria bioquímica imprescindible para realizar sus funciones esenciales. Por otro lado, el límite superior del tamaño celular puede venir dado por la velocidad de difusión de las moléculas disueltas en un medio acuoso: las células pequeñas tienen una mayor relación superficie/volumen, y su interior es por lo tanto más accesible a las sustancias que difunden hacia él a partir de su entorno.
TÉCNICAS DE ESTUDIO DE LA CÉLULA: EL MICROSCOPIO.
El ojo humano no puede apreciar objetos de tamaño inferior, en el mejor de los casos a 0,2 mm. Resulta pues evidente que, estando el tamaño de la mayoría de las células muy por debajo de este límite, el estudio de la estructura celular requerirá el uso de dispositivos capaces de generar imágenes considerablemente aumentadas de los objetos que se desea observar. Estos dispositivos se denominan microscopios(del griego micros=pequeño y scopein=mirar). Existen dos tipos de microscopio: el microscopio óptico y el microscopio electrónico:
a) Microscopio óptico.- Es un dispositivo cuyo funcionamiento se basa en las leyes de la óptica física y geométrica (Figura C). En él se combina la acción de dos lentes, llamadas objetivo y ocular, para producir una imagen virtual considerablemente aumentada del objeto observado. Una simple lente de aumento montada en un soporte adecuado para su uso se denomina tradicionalmente microscopio simple, mientras que se denomina microscopio compuesto a un dispositivo que combina dos o más lentes para generar aumentos mayores. Lo cierto es que estos términos han caído en desuso y todo el mundo llama sencillamente lupa al microscopio simple y al microscopio compuesto sencillamente microscopio. Para el estudio de la célula y de las estructuras subcelulares es preciso recurrir a los aumentos que sólo un microscopio compuesto puede producir.
La observación de estructuras biológicas al microscopio presenta algunos problemas. En primer lugar, la observación se realiza por transparencia (la luz atraviesa el objeto observado) y no por reflexión que es como estamos acostumbrados a ver los objetos corrientes. Debido a ello, las muestras del material biológico a observar deben ser láminas lo suficientemente finas (10 μm como máximo) como para que la luz pueda atravesarlas. Para obtener estas láminas se utilizan unos aparatos denominados microtomos. En segundo lugar, la materia viva es en general muy transparente a la luz visible, por lo que las imágenes obtenidas ofrecen muy poco contraste. Con el objeto de aumentar el contraste de las preparaciones microscópicas se utilizan técnicas de tinción, que consisten en el uso de diferentes colorantes que se fijan de manera selectiva a las diferentes estructuras celulares.


Microscopio electrónico
Las leyes físicas imponen una limitación al tamaño de los objetos que pueden ser observados utilizando luz del espectro visible: no se pueden obtener imágenes de un objeto cuyo tamaño sea inferior a la longitud de onda de la radiación electromagnética utilizada para generar dichas imágenes. Por lo tanto, dado que el microscopio óptico utiliza la luz del espectro visible, no cabe esperar que los avances tecnológicos permitan en el futuro diseñar microscopios ópticos con un poder de resolución mayor que el más arriba indicado. Estas consideraciones condujeron, en la década de los años 30 del siglo XX, a la invención de un dispositivo, el microscopio electrónico, que en lugar de luz visible utiliza haces de electrones acelerados.
Los electrones llevan asociada una longitud de onda considerablemente más pequeña que la de la luz visible, lo que permite obtener imágenes con un poder de resolución mucho mayor y discernir por lo tanto objetos mucho más pequeños (del orden de unos pocos nanometros). Básicamente la estructura de un microscopio electrónico es muy semejante a la de un microscopio óptico. En lugar de utilizar lentes de vidrio se utilizan lentes electromagnéticas (bobinas por las que circula electricidad) que focalizan los haces de electrones generando la imagen deseada que es recogida en una pantalla fluorescente o en una placa fotográfica (la retina humana está adaptada sólo a la luz del espectro visible y además resultaría dañada por los electrones acelerados).
Formación de moléculas sencillas en las condiciones prebióticas
En 1970 se descubrió la existencia de ácido fórmico en la región norte de la galaxia Sagittarius B2, y la confirmaron radioastrónomos de la Universidad de Illinois en 1999. Por otra parte, en 1996, científicos de esta misma universidad encontraron ácido acético en esta misma nube de gas. El ácido acético es una molécula sólo “un paso” más corta que la glicina, el aminoácido más sencillo, cuya existencia en el espacio no se ha confirmado todavía. De hecho, para la formación de glicina tan sólo habría que combinar ácido acético con amoniaco, cuya presencia en el espacio se conoce, a su vez, desde 1969.
Se descubrieron alrededor de 120 moléculas diferentes en esas nubes. Algunas de ellas tienen ocho o más átomos, como el glicoaldehído, aunque la mayoría contiene menos.
En el año 2000, un equipo de científicos formado por Jan Hollis (NASA/Goddard), Frank J. Lovas (Universidad de Illinois) y Philip R. Jewell NRAO/Green Bank) descubrió glicoaldehído en una nube gigante de gas y polvo situada a una distancia de alrededor de 26 000 años luz de la Tierra, a unos 300 años luz del centro de la galaxia, la Vía Láctea, por medio del radiotelescopio de 12 metros de la Fundación Nacional para la Ciencia, en Kitt Peak, a 80 Km de Tucson, Arizona. Tales nubes, a menudo con un tamaño de varios años luz, están compuestas por material a partir del cual se forman nuevas estrellas. Aunque su densidad es muy pequeña, se trata de zonas en las que se suceden complejas reacciones químicas a lo largo de cientos de miles o de millones de años.
FUNCIÓN CELULAR
Los organismos han evolucionado a partir de las células aisladas que flotaban en el caldo primordial (fig. 1). Una forma de comprender como se hizo posible la existencia de los organismos pluricelulares seria pensar en cómo las células aisladas mantuvieron su medio líquido interior cuando se expusieron directamente al ambiente exterior con la membrana semipermeable como única barrera. Los nutrientes de ese <caldo>entraron en la célula, disminuyendo sus gradientes de concentración a través de canales o poros y transportando los residuos hacia el el exterior mediante exocitosis. En este sencillo sistema, si el entorno externo se modificaba (p.ej., si la salinidad aumentaba debido al exceso de calor y a la evaporación consecuente del agua del mar o si cambiaba la temperatura del agua), la célula se adaptaba o parecía. Para evolucionar hacia organismos pluricelulares, las células fueron desarrollando nuevas barreras que les permitieran regular mejor su medio intracelular frente al ambiente exterior.
En los organismos pluricelulares, las células se diferencian desarrollando proteínas, sistemas metabólicos y productos intracelulares independientes. Las células con propiedades similares se unen y se convierten en tejidos, órganos y sistemas (células → tejidos →órganos → sistemas).

Figura 1 La célula en el caldo primitivo. Los primeros organismos unicelulares tenían que realizar todas sus funciones básicas y debían adaptarse a los cambios del ambiente exterior. L a membrana celular semipermeable facilitaba procesos que aportaban los nutrientes a la célula mediante difusión, endocitosis y exocitosis y los transportadores de proteínas que mantenían la homeostasis.
Hay tejidos que sirven para proporcionar soporte y permitir el movimiento ( tejido muscular), iniciar y transmitir los impulsos eléctricos ( tejido nervioso), segregar y absorber sustancias ( tejido epitelial) y unirse con otras células (tejido conjuntivo). Esos tejidos se combinan y brindan el soporte a los órganos y sistemas que controlan otras células (sistema nervioso y endocrino), aportan los nutrientes y permiten la excreción permanente de los residuos (sistema respiratorio y gastrointestinal), hacen circular los nutrientes (sistema cardiovascular), filtran y controlan las necesidades de líquidos y electrolitos y libran al cuerpo los residuos (sistema renal),proporcionan el soporte estructural (sistema esquelético) y una barrera que proteja toda la estructura( sistema integumentario [piel] (fig. 2).
El cuerpo humano está formado por células eucarióticas (con núcleo verdadero) que contienen varios orgánulos (mitocondrias, retículo endoplásmico liso y rugoso, aparato de Golgi, etc.) que cumplen funciones específicas. La célula, con su núcleo y los orgánulos, está rodeada por una membrana plasmática consistente en una bicapa lipídica formada principalmente por fosfolípidos, con cantidades variables de glucolipidos, colesterol y proteínas. La bicapa lipídica se sitúa con las colas hidrofóbicas de los ácidos grasos de los fosfolípidos enfrentados en la zona central de la membrana y los grupos hidroflilicos con sus cabezas polares orientadas hacia el espacio extracelular o intracelular. La fluidez de la membrana se mantiene en gran parte por la cantidad de ácidos grasos de la cadena corta e insaturados que forman parte de los fosfolípidos. La presencia de colesterol en la bicapa lipídica reduce su fluidez (fig 3). La región hidrofóbica liposoluble interior convierte a la bicapa en una barrera eficaz contra los líquidos (en ambos lados),lo que permite la permeabilidad solo ante algunos solutos hidrofóbicos pequeños como el etanol, que puede difundir a través de los lípidos.
Las membranas son semipermeables para acomodar las distintas funciones celulares gracias a una serie de proteínas inmersas en la bicapa lipídica. Esas proteínas son canales iónicos, receptores de ligandos, moléculas de adhesión o marcadores del reconocimiento celular. El transporte a través de la membrana conlleva mecanismos pasivos o activos y depende de la composición de la membrana del gradiente de concentración del soluto y de la disponibilidad de proteínas de transporte. Los procesos de transporte se alteran si se modifica la integridad de la membrana por un cambio de la fluidez, en la concentración de proteínas o en su grosor.

COMPARTIMIENTOS LÍQUIDOS: TAMAÑO Y ELEMENTOS CONSTITUTIVOS
Compartimientos líquidos y tamaño
El cuerpo de un adulto normal contiene aproximadamente un 60% de agua. En una persona de 70kg, esta cantidad equivale a 421 (fig. 4). El tamaño real de todos los comportamientos líquidos del cuerpo depende de varios factores, como el tamaño y el índice de masa corporal. En el adulto normal de70 kg:
-
El líquido intracelular (LIC) constituye dos terceras partes del agua corporal total y el líquido extracelular (LEC) supone el otro tercio del agua corporal total.
-
El comportamiento del líquido extracelular (LEC) esta compuesto por el plasma (sangre sin células) y el líquido intersticial (LIS), el es el líquido que baña las células (fuera del sistema vascular) y que encontramos también en el hueso y el tejido conjuntivo. El plasma constituye una cuarta parte del LEC y el LIS constituye las otras tres cuartas partes.

La cantidad de agua corporal total (ACT) varia con la edad y las características físicas. El ACT de los lactantes en rápido crecimiento supone el 75% del peso corporal, un porcentaje que se reduce con la edad. Además, influye la grasa corporal: los sujetos obesos tienen menos ACT que los sujetos de la misma edad no obesos y, en general, las mujeres tienen menos ACT que los hombres de la misma edad. La cantidad de ACT es especialmente relevante para calcular la posología de los fármacos. Como la liposolubilidad varia con el tipo de fármaco, la concentración eficaz del fármaco variara en función del contenido de agua corporal (en relación con la grasa corporal) (fig. 3).

Comportamientos intracelular y extracelular
Los comportamientos intracelular y extracelular están separados por la membrana celular. Dentro del LEC, el plasma y el líquido intersticial están separados por el endotelio y la membrana basal de los capilares. El LIS rodea las células y está en estrecho contacto con las células y el plasma.
El LIC contiene unas concentraciones de solutos diferentes que las del LEC, principalmente debido a la acción de la sodio potasio adenosina trifosfatasa (Na+/K+ Na+/ATPasa o <bomba de Na+/>) que mantiene un LEC rico en Na+ y un LIC rico K + (fig. 4). El mantenimiento de las diferentes concentraciones de solutos también depende en gran medida de la permeabilidad selectiva de las membranas celulares que separan los espacios extracelular e intracelular. Los cationes y aniones de nuestro cuerpo se encuentran en equilibrio, y el número de cargas negativas (v. fig. 6). Como el flujo iónico que atraviesa la membrana responde a las cargas eléctricas y al gradiente de solutos, el entorno global está controlado por el mantenimiento de este equilibrio electroquímico.
La osmolaridad (concentración total de solutos) de los liquidos de nuestro cuerpo es de 290 mOsm/l aproximadamente (normalmente se redondea a 300 mOsm/l para facilitar los cálculos). Este valor es cierto en todos los compartimientos de líquidos (fig. 4). Las bombas de sodio ATPasa basolaterales ( de las membranas celulares ) son esenciales para establecer y mantener los medios intracelulares y extracelulares. El Na + extracelular (y la pequeña cantidad de otros iones positivos) se equilibra con los aniones cloruro y bicarbonato y las proteínas aniónicas. En su mayor parte, la concentración de solutos es similar entre el plasma y el LIS, con la excepción de las proteínas (representadas como A), atrapadas en el espacio vascular( ya que en condiciones normales, no pueden pasar a través de la membranas capilares). La alta concentración de Na+ en el LEC impulsa la entrada de Na+en las células, así como otros muchos procesos de transporte.
El principal catión intracelular es el ion potasio, que se equilibra con los fosfatos, las proteínas y pequeñas cantidades de otros aniones. Debido a la existencia de elevados gradientes de concentración para el sodio, el potasio y el cloruro, hay un movimiento pasivo de esos iones para reducir sus gradientes. La salida de potasio hacia el exterior de la célula a través de los canales de K+ es el factor clave que contribuye al potencial de membrana en reposo. Las distintas concentraciones de sodio, potasio y cloruro a través de la membrana celular con esenciales para la generación de los potenciales eléctricos

La osmolaridad describe el número de partículas disueltas presentes en un litro de solución. En el caso de solutos no electrolíticos como la sacarosa, 1 milimol (mmol) de la sustancia es igual a 1mOsm de la solución, sin embargo, en el caso de los electrolitos es preciso tener en cuenta cada ion disociado de modo que una solución de 1mM de NaCl es igual a una solución de 2mOsm/l, y así sucesivamente. Además, las soluciones pueden describirse como isoosmóticas 8aproximadamente 300 mOsm/l), hiosmóticas (<300 mOsm/l) o hiperosmóticas (>300 mOsm/l) si se comparan con la osmolaridad normal del plasma (300 mOsm/l).
OSMOSIS Y HOMEOSTASIS DE LIQUIDOS
Osmosis
Las membranas tienen permeabilidad selectiva (semipermeables), lo que significa que permiten que algunas moléculas, pero no todas, las traviesen. Las membranas de los tejidos presentan una permeabilidad diferente para cada soluto en particular. Esta especifidad de los tejidos es fundamental para su funcionamiento, como se ve por la variación de la permeabilidad de los solutos celulares a través de la nefrona renal. Hay factores a cada lado de la membrana que se oponen o facilitan la salida del agua y los solutosde los compartimientos. Estos factores son:
-
La concentración de cada soluto. Una concentración más alta de un soluto en un lado de la membrana favorecerá el movimiento de ese soluto por difusión hacia el otro lado.
-
La concentración total de solutos. Una osmolaridad mayor en un lado proporciona un presión osmótica que <tira> del agua hacia ese espacio (difusión del agua).
-
Concentración de proteínas. Como la membrana es impermeable a las proteínas, la concentración de estas establece una presión osmótica que <tira> del agua hacia el espacio de mayor concentración.
-
La presión hidrostática, ya que es la fuerza que <empuja> el agua fuera de un espacio, por ejemplo, de los capilares al LIS(cuando la presión hidrostática en el capilar es mayor que la presión hidrostática en el LIS).
Si la membrana es permeable a un soluto, la difusión de ese soluto se producirá a favor de gradiente de concentración hacia donde la concentración es menor. No obstante, si la membrana no es permeable al soluto, el disolvente (en este caso, el agua) será <atraído> a través dela membrana hacia el comportamiento con la mayor concentración de solutos, hasta que la concentración de estos alcance el equilibrio a ambos lados de la membrana. El movimiento de agua a través de la membrana por difusión se denomina osmosis y la permeabilidad de la membrana determina si se produce por la difusión de solutos o por osmosis (movimiento del agua). La concentración de un soluto no permeable determinara cuánta agua de desplazar a través de la membrana para conseguir el equilibrio osmolar entre el LEC Y EL LIC.
Como la osmolaridad de una solución describe la concentracion de partículas disueltas, una solución puede considerarse hipoosmótica, isoosmotica o hiperosmoticacon respecto a otra. El movimiento de líquido entre dos soluciones isoosmoticas a través de una membrana dependerá de si los solutos son permeables. Cuando se infunde al plasma (LEC) sacarosa, un monosacárido impermeable para las células, permanecerá en el compartimiento del LEC. Así pues, una solución de sacarosa de 300 mOsm/l será isotónica con respecto a las células con una osmolaridad normal de 300 mOsm/l, con lo que no habrá movimiento de líquido. Una solución de sacarosa de más de 300 mOsm/l es hipertónica respecto a la osmolaridad celular normal. A diferencia de los solutos impermeables, uno permeable, como la urea, difundirá libremente al interior de las células hasta que alcance el equilibrio. De este modo, una solución de urea de 300 mOsm/l será hipotónica, incluso aunque la solución sea isoosmotica. Cuando una solución como esta se infunde en el LEC, provocara expansión del comportamiento del LIC.
La osmosis se produce cuando hay una diferencia de presión osmótica. La presión osmótica equivale a la presión hidrostática necesaria para evitar el movimiento de líquido por osmosis a través dela membrana semipermeable. La idea se puede representar usando un tubo en forma de U con distintas concentraciones de soluto aun lado y otro de una membrana semipermeable (es decir, permeable al agua pero impermeable al soluto) (fig. 5 A).
Debido a la desigual concentración de soluto, el líquido se desplaza hacia el lado que presenta mayor concentración de solutos (lado derecho del tubo) en contra de la presión hidrostática que se opone a ella , hasta que se iguale la presión hidrostática generada con la presión osmótica. En el ejemplo, en el equilibrio, la concentración del soluto es casi igual y el nivel de agua es desigual, el desplazamiento del agua se debe a la presión osmótica (fig. 5 B).
En el plasma, la presencia de proteínas también causa una presión oncótica importante que se opone a la presión hidrostática (filtración hacia el exterior del comportamiento) y se considera la presión osmótica efectiva del capilar.

Transporte a través de membranas
La bicapa lipídica de la membrana actúa como una barrera que separa dos medios acuosos: el medio donde vive la célula y el medio interno celular.
Las células requieren nutrimentos del exterior, deben eliminar sustancias de desecho procedentes del metabolismo y mantener su medio interno estable. La membrana manifiesta una permeabilidad selectiva, ya que permite el paso de pequeñas moléculas, siempre que sean lipófilas, pero regula
el paso de moléculas no lipófilas.
El paso a través de la membrana posee dos modalidades, una pasiva, sin gasto de energía, y otra activa, con consumo de energía.
Transporte pasivo
Es un proceso de difusión de sustancias a través de la membrana. Se produce siempre a favor del gradiente, es decir, del ambiente donde hay más hacia el medio donde hay menos.Este transporte se efectúa por difusión simple.
Difusión simple
Es el paso de pequeñas moléculas a favor del gradiente; se puede producir a través de la bicapa lipídica o a través de canales proteicos.
1. Difusión simple a través de la bicapa. De este modo entran moléculas lipídicas como las hormonas esteroides, anestésicos como el éter y fármacos liposolubles, así como sustancias apolares como el oxígeno y el nitrógeno atmosférico. También algunas moléculas polares muy pequeñas, como el agua, el CO2, el etanol y el glicerol, atraviesan la membrana por difusión simple. La difusión del agua recibe el nombre de ósmosis.
2. Difusión simple a través de canales. Se realiza mediante las denominadas proteínas de canal. Así entran iones como el Na+, K+, Ca2+, Cl—. Las proteínas de canal son proteínas que forman un orificio o canal interno, cuya apertura está regulada, por ejemplo por ligandos, como
ocurre con los neurotransmisores o las hormonas, que se unen a una determinada región, o el receptor de la proteína de canal, que sufre una transformación estructural que induce la apertura del canal.
3. Difusión facilitada. Permite el transporte de pequeñas moléculas polares, como los aminoácidos, monosacáridos, etc., que al no poder atravesar la bicapa lipídica, requieren que proteínas transmembrana faciliten su paso. Estas proteínas reciben el nombre de proteínas transportadoras o permeasas, las cuales, al unirse a la molécula que tienen que transportar sufren un cambio tal en su estructura que arrastra a dicha molécula hacia el interior de la célula.
Transporte activo
En este proceso también actúan proteínas de membrana, pero éstas requieren energía, en forma de ATP, para transportar las moléculas al otro lado de la membrana. Tienen lugar cuando el transporte se realiza en contra del gradiente electroquímico.
Son ejemplos de transporte activo la bomba de Na+/K+ y la bomba de Ca2+.La bomba de Na+/K+ requiere una proteína transmembrana que expele Na+ hacia el exterior de la membrana y conduce K+ hacia el interior. Esta proteína actúa contra el gradiente gracias a su actividad como ATP—asa, ya que rompe el ATP para obtener la energía necesaria para el transporte. Mediante este mecanismo, se envían tres Na+ hacia el exterior y se incorporan dos K+ en el interior, con la hidrólisis acoplada de ATP.
El transporte activo de Na+ y K+ tiene una gran importancia fisiológica. De hecho, todas las células animales gastan más del 30% del ATP que producen (y las células nerviosas más del 70%) para movilizar estos iones.
ORGÁNULOS MEMBRANOSOS
Membrana plasmática
La membrana plasmática es una estructura de bicapalipídica visible con microscopía electrónica de transmisión.
La membrana plasmática (membrana celular, plasmalema) es una estructura dinámica que participa en forma activa en muchas actividades fisiológicas y bioquímicas esenciales para el funcionamiento y la supervivencia de la célula. Cuando la membrana plasmática se fija, se secciona, se tiñe y se observa en forma apropiada con el microscopio electrónico de transmisión (MET), aparece formada por dos capas electrodensas separadas por una capa intermedia electrolúcida (no teñida) (fig. 6). El espesor total de la membrana plasmática es alrededor de 8 a 10nm.

Figura 6. Fotomicrografía de las microvellosidades en la superficie apical de una célula absortiva. Esta fotomicrografía muestra la porción apical de las células absortivas con microvellosidades.
Obsérvese que en esta magnificación, la membrana plasmática muestra su apariencia característica de dos líneas electrodensas separadas por una capa electrolúcida intermedia.
Las glucoproteínas del glucocáliz pueden extenderse desde los extremos de las microvellosidades en el lumen.
La relación entre la hojuela externa de la membrana plasmática y el glucocáliz han sido particularmente bien demostradas.
Las glucoproteínas del glucocáliz incluyen enzimas digestivas terminales, como dipeptidasas y disacaridasas. 100 000 X. (Gentileza del Dr. Ray C. Henrikson).
La membrana plasmática está compuesta por una capa de lípidos anfipáticos que contiene proteínas integrales y proteínas periféricas adheridas a sus superficie.
La interpretación actual de la organización molecular de la membrana plasmática consiste en el llamado modelo de mosaico fluido modificado (fig. 7). La membrana está compuesta principalmente por moléculas de fosfolípidos, colesterol, y proteínas. Las moléculas de lípido forman una bicapa lipídica de carácter anfipático (tanto hidrófoba como hidrófila). Las cadenas de ácidos grasos de las moléculas lipídicas se enfrentan entre sí, tornando hidrófoba (es decir, que no tiene afinidad por el agua) la porción interna de la membrana. Las superficies de la membrana están formadas por los grupos polares de las cabezas de las moléculas lipídicas, haciendo de este modo que las superficies se tornen hidrófilas (es decir, con afinidad por el agua). Los lípidos se distribuyen en forma asimétrica entre las hojuelas interna y externa de la bicapa lipídica, y su composición varia en forma considerable entre las diferentes membranas biológicas.

Figura 7. Diagrama de la membrana plasmática que presenta el modelo de mosaico fluido modificado. La membrana plasmática es una bicapa lipídica compuesta principalmente por moléculas de fosfolípidos, colesterol y moléculas de proteínas. Las cadenas hidrófobas de los ácidos grasos se enfrentan para formar la porción interna de la membrana, mientras que las cabezas polares hidrófilas de los fosfolípidos forman las superficies intracelular y extracelular de la membrana. Las moléculas de colesterol son incorporadas dentro de los espacios entre los fosfolípidos en forma equivalente en ambos lados de la membrana. Obsérvese el área sobreelevada de la balsa lipídica, que se caracteriza por una alta concentración de glucoesfingolípidos y colesterol. Contiene una gran cantidad de proteínas integrales y periféricas de la membrana. La balsa sobresale por encima del nivel de fosfolípidos distribuidos asimétricamente en la bicapa de la membrana (indicado por los diferentes colores de las cabezas de fosfolípidos). Las cadenas de hidratos de carbono se unen tanto a las proteínas de membrana integrales y periféricas para formar glucoproteínas, como a las cabezas polares de los fosfolípidos para formar glucolípidos.
En la mayoría de las membranas plasmáticas, las moléculas de proteína constituyen aproximadamente la mitad de la masa total de la membrana. La mayor parte de las proteínas están embebidas en la bicapa lipídica o la atraviesan por completo. Estas proteínas se denominan proteínas integrales de mem- brana. Los otros tipos de proteínas (proteínas periféricas de membrana) no están inmersas dentro de la bicapa lipídica. Éstas e asocian con la membrana plasmática por medio de interacciones iónicas fuertes, principalmente con proteínas integrales en la superficie extracelular e intracelular de la membrana (v. fig. 7). Además, en la superficie extracelular de la membrana plasmática, los hidratos de carbono pueden adherirse a las proteínas, y de ese modo formar glucoproteínas; o a los lípidos de la bicapa, y así formar glucolípi- dos. Estas moléculas de superficie constituyen una capa en la superficie de la célula que se conoce como cubierta celular o glucocáliz (v. fig. 6). Contribuyen a establecer microambientes extracelulares en la superficie de membrana que cumplen funciones específicas en el metabolismo, en el reconocimiento celular, y en la asociación celular, y sirven como sitios receptores para hormonas.
Los microdominios de la membrana plasmática, conocidos como balsas lipídicas, controlan el movimiento y la distribución de las proteínas dentro de la bicapa lipídica.
La fluidez de la membrana plasmática no puede observarse en fotomicrografías electrónicas estáticas. Los experimentos revelan que la membrana se comporta como si fuera un fluido lipídico bidimensional. Durante muchos años, se creyó que las proteínas integrales de membrana se movían libremente dentro del plano de la membrana; este movimiento se comparó con el movimiento de los témpanos de hielo flotando en el océano (v. fig. 7). Sin embargo, estudios recientes muestran que la distribución y el movimiento de las proteínas dentro de la bicapa lipídica no son tan aleatorios como se creía.
La membrana plasmática parece ser irregular con dominios localizados que tienen diferentes funciones y estructuras, y varían en espesor y composición. Estos dominios focalizados contienen altas concentraciones de colesterol y glucoesfingolípidos, y se denominan balsas lipídicas. Debido a la alta concentración de colesterol y a la presencia de cadenas largas de ácidos grasos altamente saturados, la superficie de la balsa lipídica es más gruesa y muestra una menor fluidez que la membrana plasmática circundante (Figura 8). El colesterol es un "pegamento" dinámico que mantiene a la balsa unida; su remoción de la misma produce la dispersión de los lípidos y las proteínas asociadas.

Figura 8. Imagen de balsas lipídicas obtenida con microscopio de fuerza atómica (MFA) operando en modo de per- cusión. La imagen muestra una bicapa lipídica de 5nm de espesor extendida sobre el soporte de mica. La bicapa está compuesta por dioleoilfosfatidilcolina (dioleoil- PC), esfingomielina y colesterol. La esfingo- mielina junto con el colesterol forman balsas lipídicas representadas en la imagen por las áreas rosadas; las áreas azul -púrpura corresponden al fondo de la bicapa que no es almadía. Dado que las moléculas de esfingomielina son más largas que las moléculas de dioleoil-PC, las balsas sobresalen alrededor de 0,8nm por arriba del nivel del fondo y el MFA tiene la sensibilidad suficiente para detectar esta protrusión. Las regiones negras representan el soporte de mica. La imagen también mues- tra moléculas de la toxina VacA helicobacter pylori (partículas blancas), las que se unen con preferencia a los receptores protéicos en las áreas de las balsas. La superficie ilustrada en esta imagen es de 800 nm cuadrados (Gentileza de los Drs. Nicholas A. Geisse, Timothy L. Cover, Robert M. Hen- derson y J. Michael Edwardso).
En general, existen dos tipos de balsas lipídicas:
- Balsas lipídicas planas contienen una familia de proteínas de 47kDa conocidas como flotilinas, además de la composición específica de lípidos y colesterol. Las flotilinas se valoran como marcadores moleculares de las balsas lipídicas y son consideradas como proteínas de andamiaje.
También participan en el reclutamiento de proteínas específicas de la membrana en las balsas y trabajan como socios activos en varios procesos de señalización.
- Balsas caveolares, o caveolas (lat. caveolae = cuevas pequeñas), representan pequeñas invaginaciones de la membrana plasmática en forma de botella (50 a 100nm de diámetro), enriquecidas con pequeñas proteínas integrales de membrana (18 a 24kDa) denominadas caveolinas. Estas proteínas tienen la capacidad de unirse al colesterol y a una variedad de proteínas que participan en la transducción de señales.
Las balsas lipídicas contienen una variedad de proteínas de membrana integrales y periféricas involucradas en la señalización celular. Pueden considerarse como “plataformas de señalización” que flotan en el océano de lípidos. Cada balsa individual está equipada con todos los elementos necesarios (receptores, factores de acoplamiento, enzimas efectoras y sus- tratos) para recibir y transmitir señales específicas.
La transducción de las señales en las balsas lipídicas ocurre con más rapidez y en forma más eficiente debido a la estrecha proximidad de las proteínas que interaccionan. Además, diferentes balsas de señalización permiten que las moléculas de señalización específicas estén separadas entre sí.
En infecciones bacterianas y víricas, el contacto inicial del microorganismo con la célula se produce en la balsa. Algunas bacterias (p.ej., Shigella flexneri, Salmonella typhimurium) secuestran las balsas con sus mecanismos de señalización y las usan para permitir su propia entrada a la célula. Muchas bacterias utilizan las balsas para evitar la fagocitosis y la subsecuente destrucción en los lisosomas. En otros casos, las bacterias invasoras utilizan receptores asociados a la balsa para generar vacuolas formadas con componentes de la balsa. Estas vacuolas son utilizadas para transportar bacterias dentro de la célula sin el riesgo de ser detectadas por compartimentos fagocíticos.
Las proteínas integrales de la membrana pueden visualizarse mediante el uso de la criofractura, una técnica de preparación histológica especial.
La existencia de proteína dentro de la sustancia de la membrana plasmática (es decir, proteínas integrales) fue confirmada por una técnica llamada criofractura. Cuando se prepara el tejido para la microscopia electrónica con el procedimiento de criofactura (fig. 9 a), normalmente las membranas se parten o dividen a lo largo del plano hidrofóbico (es decir, entre las dos capas lipídicas) para exponer las dos caras internas de la membrana, la cara E y la cara P (fig. 9 b).


Figura 9. Examen de la membrana plasmática mediante criofractura. a. Vista de la membrana plasmática desde el borde, donde la flecha señala el plano de fractura preferencial de la bicapa lipídica a lo largo de la porción hidrófoba de la membrana. Cuando la membrana se quiebra, algunas proteínas son transportadas con la hojuela externa, aunque la mayoría son retenidas dentro de la hojuela interna. b. Vista de la membrana plasmática con las hojuelas separadas a lo largo del plano de fractura. Las superficies de la membrana fracturada son revestidas, formando réplicas; las réplicas se separan del tejido y se examinan bajo el microscopio electrónico de transmisión (MET). Las proteínas aparecen como eminencias. La réplica de la hojuela interna se llama cara- P; detrás de ella se encuentra el citoplasma (protoplasma). Una vista de la hojuela externa se llama cara –E; detrás de ella se encuentra el espacio extracelular. c. Fotomicrografía electrónica de la réplica de una criofractura que muestra la cara –E de la membrana de una célula epitelial y la cara –P de la membrana de la célula contigua. El plano de fractura ha saltado de la membrana de una célula a la membrana de otra, como lo indica el espacio claro (espacio intercelular) que atraviesa la mitad de la figura. Obsérvese la escasez de partículas en la cara –E en comparación con la cara –P, desde la cual se proyecta la mayor parte de las proteínas integrales de la membrana. (Gentileza de la Dra. Giuseppina d’Elia Raviola.)
La cara E tiene por detrás el espacio extracelular, mientras que la cara P tiene por detrás el citoplasma (protoplasma). Las numerosas partículas observadas con el MET en las caras E y P representan las proteínas integrales de membrana. La cara P suele exhibir más partículas, por lo tanto más proteína, que la cara E.
Las proteínas integrales de membrana cumplen funciones importantes en el metabolismo, regulación, integración, y señalización celular.
Se han definido seis amplias categorías de proteínas de membrana en lo que se refiere a su función: bombas, conductos, receptores, proteínas de enlace, enzimas y proteínas estructurales (fig. 11). Las categorías no son mutuamente excluyentes (p.ej., una proteína de membrana estructural puede servir en forma simultánea como un receptor, una enzima, una bomba, o cualquier combinación de estas funciones.

Figura 11. Diferentes funciones de las proteínas integrales de la membrana. En este diagrama se muestran las seis principales categorías de las proteínas integrales de la membrana: bombas, conductos, receptores, ligadores, enzimas y proteínas estructura- les. Estas categorías no son mutuamente excluyentes. Una proteína estructural de la membrana que participa en las uniones intercelulares puede servir en forma simultánea como un receptor, enzima, ligador o cualquier combinación de estas funciones.
- Las bombas sirven para transportar activamente ciertos iones, como el Na+, a través de las membranas. Las bombas también transportan a través de las membranas precursores metabólicos de macromoléculas, como aminoácidos y monosacáridos, ya sea en forma individual o ligados a una bomba de Na+.
- Los conductos permiten el paso de pequeños iones, moléculas y agua a través de la membrana plasmática en cualquier dirección (es decir, mediante difusión pasiva). Las uniones de hendidura, formadas por conductos alineados en las membranas de células contiguas, permiten el paso de iones y moléculas pequeñas implicadas en los procesos de señalización, desde el citoplasma de una de las células al citoplasma de células contiguas.
- Las proteínas receptoras permiten el reconocimiento y la unión específica de ligandos (moléculas que se unen a la superficie extracelular de la membrana plasmática) en procesos como la estimulación hormonal, endocitosis de vesículas con cubierta, y reacciones con anticuerpos. Los receptores que se unen a moléculas de señalización transmiten la señal a través de una secuencia de interruptores moleculares (o sea, segundos mensajeros), a los mecanismos de señalización internos, iniciando así, una respuesta fisiológica.
- Las proteínas de enlace fijan el citoesqueleto intracelular a la matriz extracelular. Entre los ejemplos de proteínas de enlace se encuentra la familia de las integrinas que vinculan los filamentos de actina del citoplasma con una proteína de la matriz extracelular (fibronectina).
- Las enzimas tienen una gran variedad de funciones. Las adenosina trifosfatasas (ATPasas) desempeñan papeles específicos en el bombeo de iones: la ATP sintasa es la principal proteína de la membrana mitocondrial interna, y las enzimas digestivas como disacaridasas y dipeptidasas, son proteínas integrales de membrana.
- Las proteínas estructurales se visualizan mediante el mé- todo de criofractura, especialmente donde forman uniones con células vecinas. A menudo, ciertas proteínas y lípidos se concentran en regiones localizadas de la membrana plasmática para cumplir funciones específicas. Ejemplos de dichas regiones pueden identificarse en las células pola- rizadas, como las células epiteliales.
A continuación podrás apreciar en la siguiente tabla, los métodos de tinción más utilizados para observar tejidos celulares a través de un microscopio, así como diversos ejemplos de ellos.

Repasemos las generalidades de esta unidad
CONCEPTOS CLAVE
Las células son unidades estructurales y funcionales básicas de todos los organismos multicelulares
Los procesos que normalmente asociamos con las actividades diarias de los organismos (protección, ingestión, digestión, absorción de metabolitos, eliminación de residuos, movimiento, reproducción y hasta la muerte) son todos reflejos de procesos similares que ocurren dentro de cada una de los billones de células que constituyen el cuerpo humano. En gran medida, células de diferentes tipos utilizan mecanismos similares para sintetizar proteína, transformar energía y mover sustancias esenciales hacia la célula. Usan los mismos tipos de moléculas para contraerse y duplican su material genético de la misma manera.
Las funciones específicas se identifican con componentes y dominios estructurales específicos dentro de la célula. Algunas células desarrollan una o más de estas funciones en un grado tal de especialización que son identificadas por la función y las estructuras celulares asociadas con ellas. Por ejemplo, si bien todas las células contienen proteínas de filamentos contráctiles, algunas células, como las células musculares, contienen grandes cantidades de estas proteínas en una organización específica. Esto les permite realizar su función especializada de contracción tanto en el nivel celular como en el nivel tisular. La actividad o función especializada de una célula puede ser un reflejo no sólo de la presencia de una gran cantidad del componente estructural específico que realiza la actividad, sino también de la forma de la célula, su organización con respecto a otras células similares, y sus productos (fig.1).



Características histológicas de diferentes tipos celulares. Estas tres fotomicrografías muestran distintos tipos celulares en tres órganos diferentes del cuerpo. Las caracteristicas distintivas son tamaño, forma, orientación y contenido citoplasmático que puede relacionarse con la función o actividad especializada de cada célula. a. Células epiteliales en el riñón. Obsérvense diferentes formas de células epiteliales: células cilindricas con bordes bien definidos en el conducto collector (CD), células escamosas en el segmento delgado (TS) de la nefrona y células aún más aplanadas revisitiendo vasos sanguíneos, los vasos rectos del riñón (VR). 380 X. b. Células ganglionares de la raíz dorsal. Obsérvese el gran tamaño de estos cuerpos de células nerviosas, núcleos (N) pálidos (eucromáticos) con marcados nucléolos. Cada célula ganglionar está rodeada por células satelite aplanadas (S). El tamaño de la célula ganglionar y la presencia de un núcleo eucromático, un nucléolo prominente y corpúsculos de Nissl (retículo endoplásmico de superficie rugosa visible como gránulos más oscuros dentro del citoplasma) reflejan la extensa actividad sintética necesaria para mantener los procesos excesivamente largos (axones) de estas células. 380X. c. Células musculares lisas del intestino delgado. Obsérvese que estas células son tipicamente alargadas, fusiformes y organizadas en una matriz paralela. Los núcleos también se alargan para adecuarse a la forma general de la célula. 380 X.
Las células pueden dividirse en dos compartimentos principales: el citoplasma y el núcleo. En general, el citoplasma es la región de la célula localizada fuera del núcleo. El citoplasma contiene orgánulos (“órganos pequeños”), citoesqueleto formado por proteínas polimerizadas que forman microtúbulos, filamentos intermedios y filamentos de actina), e inclusiones suspendidas en un gel acuoso denominado matriz citoplasmática. La matriz consiste en una variedad de solutos, que incluye iones inorgánicos (Na+, K+, Ca2+) y moléculas orgánicas como metabolitos intermedios, hidratos de carbono, lípidos, proteínas y ARN. La célula controla la concentración de solutos dentro de la matriz, lo que influye en el ritmo de actividad metabólica dentro del compartimento citoplasmático. El núcleo es el orgánulo más grande dentro de la célula y contiene el genoma junto con las enzimas necesarias para la replicación de ADN y la transcripción de ARN. El citoplasma y el núcleo no sólo desempeñan diferentes papeles funcionales sino que también trabajan en conjunto para mantener la viabilidad celular.
Los orgánulos se describen como membranosos (limitados por membrana) o no membranosos.
Los orgánulos incluyen sistemas membranosos de la célula y compartimentos limitados por membrana que realizan las funciones celulares catabólicas, anabólicas, dependientes de energía y generadoras de energía, así como componentes estructurales no membranosos. Todas las células tienen el mismo conjunto básico de orgánulos, los que pueden clasificarse en dos grupos: (1) orgánulos membranosos con membranas plasmáticas que separan el ambiente interno del orgánulo del citoplasma y (2) orgánulos no membranosos carentes de membrana plasmática.
Las membranas de los orgánulos membranosos adoptan formas vesiculares, tubulares y otros patrones estructurales en el citoplasma que pueden estar enrollados (como en el retículo endoplásmico liso) o plegados (como en la membrana mitocondrial interna). Estas organizaciones de membrana aumentan en gran medida la superficie en la que tienen lugar las reacciones fisiológicas y bioquímicas esenciales. Los espacios encerrados por las membranas de los orgánulos constituyen los microcompartimentos intracelulares en los que los sus- tratos, productos, y otras sustancias son aislados o concentrados. Además, cada tipo de orgánulo contiene un grupo de proteínas específicas; en los orgánulos membranosos, estas proteínas se encuentran incorporadas en sus membranas o en su espacio interno. Por ejemplo, las enzimas de los lisosomas están separadas de la matriz citoplasmática por una membrana específica resistente a enzimas debido a que su actividad hidrolítica podría ser perjudicial para la célula. En orgánulos no membranosos, sus proteínas específicas a menudo se autoensamblan en polímeros que forman los elementos estructurales del citoesqueleto.
Además de los orgánulos, el citoplasma contiene inclusiones, estructuras que no suelen estar rodeadas por una mem- brana plasmática. Éstas consisten en diferentes materiales como cristales, gránulos de pigmento, lípidos, glucógeno, y otros productos de deshecho almacenados.
Los orgánulos membranosos incluyen:
-
Membrana plasmática (celular), una bicapa lipídica que forma el límite de la célula como también los límites de muchos orgánulos dentro de la célula;
-
Retículo endoplásmico rugoso (RER), una región del retículo endoplásmico asociada con ribosomas en donde se sintetizan y modifican proteínas;
-
Retículo endoplásmico liso (REL), una región del retículo endoplásmico carente de ribosomas involucrada en la síntesis de lípidos y esteroides;
-
Aparato de Golgi, un orgánulo membranoso compuesto por múltiples cisternas aplanadas responsables de la modificación, clasificación y empaquetamiento de proteínas y lípidos para su transporte intracelular o extracelular;
-
Endosomas, compartimentos limitados por membrana que participan en los mecanismos de endocitosis, cuya función principal es la de clasificar las proteínas que le son enviadas por las vesículas endocíticas, y redirigirlas a diferentes compartimentos celulares que serán sus destinos finales;
-
Lisosomas, orgánulos pequeños con enzimas digestivas que se forman a partir de vesículas que se desprenden del aparato de Golgi que contienen proteínas de membrana específicas del lisosoma y enzimas lisosómicas;
-
Vesículas de transporte (incluidas las vesículas pinocíticas, las vesículas endocíticas y las vesículas con cubierta) que están involucradas en la endocitosis y la exocitosis, y varían en la forma y el material que transportan;
-
Mitocondria, orgánulos que proporcionan la mayor parte de la energía a la célula al producir adenosina trifosfato (ATP) en el proceso de fosforilación oxidativa;
-
Peroxisomas, orgánulos pequeños involucrados en la producción y degradación de H2O2 y en la degradación de ácidos grasos.
Los orgánulos no membranosos son:
-
Microtúbulos, que junto con filamentos de actina e intermedios forman elementos del citoesqueleto y constantemente se alargan (mediante la adición de dímeros de tubulina) y se acortan (mediante la extracción de dímeros de tubulina), una propiedad conocida como inestabilidad dinámica;
-
Filamentos, que también son parte del citoesqueleto y pueden clasificarse en dos grupos: filamentos de actina, que son cadenas flexibles de moléculas de actina, y filamentos intermedios, que son fibras parecidas a cuerdas formadas a partir de diversas proteínas; ambos grupos proporcionan resistencia a la tracción para soportar la tensión y confieren resistencia a las fuerzas de cizallamiento;
-
Centríolos, par de estructuras cilíndricas cortas que se encuentran en el centro de organización de microtúbulos (MTOC, por su sigla en inglés) o centrosoma, y cuyos derivados originan los cuerpos basales de los cilios;
-
Ribosomas, estructuras esenciales para la síntesis de proteínas, y que están compuestas por ARN ribosomal (ARNr) y proteínas ribosomales (incluyendo las proteínas adheridas a membranas del RER y proteínas libres en el citoplasma); y
-
Proteasomas, complejos de proteínas que degradan enzimáticamente proteínas dañadas o innecesarias en polipéptidos pequeños y aminoácidos.
ACTIVIDADES DE APRENDIZAJE
1.- Comprensión de lectura
Analice el contexto de las siguientes preguntas en base a la información expuesta en esta unidad y remita sus respuestas al correo electrónico: actividades@institutosuperiordeneurociencias.org
1.- ¿Cuál es la distinción entre átomos, moléculas, protones, neutrones y electrones?
2.- ¿En qué consisten los niveles de energía según el modelo atómico de Bohr?
3.- ¿Qué son los enlaces químicos?
4.- ¿En qué consisten las propiedades de la estructura atómica?
5.- ¿Cómo se clasifican los compuestos atómicos y cual es la importancia del carbono?
6.- ¿Qué es una célula y como se organizan o clasifican?
7.- ¿Cuáles son las estructuras que componen a una célula?
8.- ¿Por qué considera que es importante el estudio de la osmosis y la homeostasis de líquidos en el cuerpo humano?
9.- ¿Qué son los órganulos membranosos?
10.- ¿Qué son las balsas lipídicas?
Material de apoyo
2.- Identificación y coloreo de estructuras.
Descarga el siguiente archivo en PDF, identifica cada una de las estructuras señaladas en las imágenes y coloréalas.
La creatividad es importante para esta actividad que será un referente en todo el curso.
Envía tus imágenes al correo: tareasconsejomxneurociencias@gmail.com y compártelas en el foro de discusión.
Se eligirán las mejores imágenes y se compartirán en nuestra fan page en facebook. Los ganadores obtendrán 1 punto adicional para la evaluación de esta unidad.
Las actividades de aprendizaje representan el 30% de la calificación de la evaluación y se requiere un mínimo de 8 puntos para acreditarla.
IMPORTANTE:
Es muy importante tomar en consideración que los plazos para la entrega de actividades, aparecerán a un costado del botón que permite el acceso a esta unidad situado en el menú de este diplomado.
¿Requieres apoyo? contáctanos a través del siguiente formulario.

